
Coronavirus porcinos
Héctor Puente
Investigador Posdoctoral Juan de la Cierva de la Universidad de Córdoba (UCO)

Los coronavirus van a afectar a cerdos de cualquier edad, aunque las consecuencias de la diarrea que provocan son particularmente graves en los lechones menores de 2 semanas, pudiéndose alcanzar letalidades próximas al 90‒100 % en las presentaciones más graves de la enfermedad.
Etiopatogenia
Los coronavirus (CoV) son virus de la familia Coronaviridae, que se clasifican en cuatro géneros: Alphacoronavirus, Betacoronavirus, Gammacoronavirus y Deltacoronavirus. Los CoV son virus pleomórficos y con envoltura, que presentan un genoma de ARN monocatenario (25-30 kb) de polaridad positiva.
Dos tercios del genoma codifican para hasta 16 proteínas no estructurales necesarias para la replicación del ARN, mientras que el último tercio del genoma codifica al menos para cuatro proteínas estructurales comunes a todos los CoV: N (nucleocápside), S (espícula), E (envoltura) y M (membrana); y una o más proteínas no estructurales.
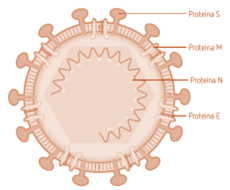
La proteína S es una glicoproteína que constituye los peplómeros o espículas y que, además de dar una apariencia de corona a este agente, es la responsable de la unión específica a los receptores celulares, permitiendo la entrada del virus en la célula del hospedador y determinando el tropismo, y la principal responsable de la inducción de anticuerpos neutralizantes
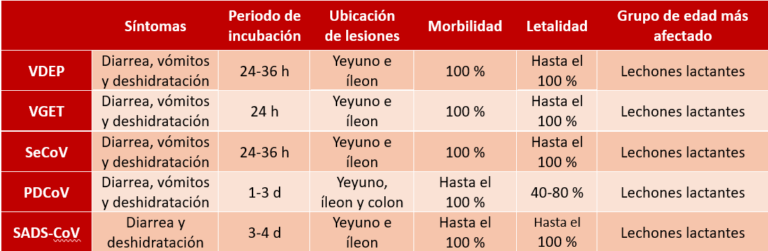
Además de los alfacoronavirus clásicamente conocidos, el Virus de la gastroenteritis transmisible porcina (VGET) y el Virus de la diarrea epidémica porcina (VDEP), hay otros tres coronavirus porcinos de más reciente descripción. El Deltacoronavirus porcino (SDCoV) circula en explotaciones porcinas de Asia y del continente americano, mientras que el Coronavirus del síndrome de la diarrea grave (SADS-CoV) es un alfacoronavirus recientemente adaptado al hospedador porcino, originado a partir de un virus de murciélagos e identificado en un número limitado de brotes de enfermedad entérica en granjas porcinas de China.
Finalmente, el Coronavirus entérico porcino o SeCoV es un virus quimérico generado por la recombinación del VGET y el VDEP, y que ha circulado por explotaciones porcinas del continente europeo. Los estudios más recientes sobre la etiología de las infecciones por coronavirus en las granjas porcinas españolas concluyen que el VDEP es el principal coronavirus implicado en brotes de enfermedad entérica en este ámbito.
En todas estas infecciones, el cuadro clínico se inicia tras la entrada del virus en una granja previamente negativa, provocando brotes epidémicos muy evidentes, con elevada morbilidad (presentación epidémica). La malabsorción asociada a la destrucción de los enterocitos maduros de la vellosidad intestinal del intestino delgado es consecuencia de la replicación viral que produce lesiones de acortamiento de las vellosidades. Los cuadros de diarrea suelen aparecer a los 2-4 días de la infección, mientras que la eliminación viral en las heces suele comenzar antes por lo que el animal infectado es capaz de excretar el virus en las heces antes de presentar signos de la enfermedad. Ocasionalmente, estos coronavirus son capaces de persistir en las granjas tras el brote epidémico inicial, circulando entre los cerdos destetados, cuando pierden la inmunidad maternal, así como entre los animales de reposición, cursando con morbilidad baja y sin producir bajas (presentación endémica).
Diagnóstico
Al igual que pasaba con los rotavirus (RV), las lesiones y signos clínicos asociados a estos CoV son indistinguibles entre ellos y también de otros enteropatógenos, siendo necesarias pruebas de laboratorio para llegar a un diagnóstico etiológico definitivo y correcto.
Las técnicas moleculares de PCR precedidas de transcripción reversa (RT-PCR) y realizadas sobre el ARN extraído de las heces o del contenido intestinal son empleadas de forma habitual para la detección directa de CoV. Una de las ventajas del diagnóstico de CoV entéricos es que, al contrario de lo que nos pasaba con los RV, la detección por si sola de estos agentes se consideran siempre causa de enfermedad digestiva.
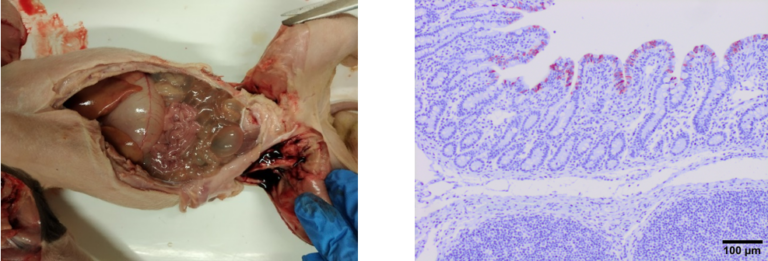
La observación de lesiones de acortamiento en las vellosidades del intestino delgado nos va a permitir conocer el grado de lesión existente y si las acompañamos de técnicas de inmunohistoquímica con anticuerpos específicos, vamos a poder relacionar la presencia del agente con las lesiones producidas por su replicación viral.
Adicionalmente, existen test rápidos de inmunocromatografía para la detección de CoV como el VDEP y el VGET, con una sensibilidad inferior a la de las técnicas moleculares, pero que debido a la elevada concentración viral que se elimina en las heces en los brotes de diarrea y unido a la ventaja de poder realizarse en pocos minutos y en condiciones de granja, los convierte en herramientas útiles.
Finalmente, el uso de pruebas serológicas para la identificación de anticuerpos específicos frente a algunos CoV entéricos solo nos va a resultar útil para conocer el estatus de exposición previa de un individuo a ese agente.
Aspectos claves en prevención y control
De nuevo, no existe ningún tratamiento específico, aunque algunos trabajos recientes atribuyen a determinados extractos de plantas un efecto anti-VDEP. La deshidratación es la principal causa de mortalidad, por lo que el empleo de soluciones electrolíticas para rehidratar a los lechones de menos de 2 semanas afectados puede mejorar de forma clara la evolución del proceso en lactación. En los animales adultos, la retirada del alimento sólido durante 12-24 horas y, muy especialmente, la administración de antipiréticos o analgésicos como el paracetamol, puede mejorar la evolución de forma significativa, al disminuir la fiebre y el malestar de los animales.
Con el fin de minimizar los efectos en los lechones más jóvenes y las pérdidas por los brotes de diarrea, es necesario potenciar la transferencia de inmunidad materna. En Asia y en Estados Unidos se han empleado vacunas frente al VDEP, tanto vivas atenuadas como inactivadas o de subunidades, que se aplican a las reproductoras generalmente por vía parenteral o por vía oral, pero en el continente europeo no se ha autorizado, por el momento, ninguna vacuna contra el VDEP.
En ausencia de vacunas, esta estimulación de la inmunidad se lleva a cabo mediante la exposición de las reproductoras a material infeccioso (por vía oral), fundamentalmente heces o contenido intestinal de lechones sacrificados en la fase aguda de la infección (feedback). Esta exposición se debe realizar en todas las reproductoras de la explotación, excepto aquellas cuyo parto este previsto en los próximos 10-14 días al no disponer del tiempo necesario para poder alcanzar una adecuada inmunidad. Los principales problemas del feedback derivan de la falta de homogeneidad del material infeccioso preparado, así como del desconocimiento de la presencia en el mismo de otros microorganismos patógenos. Por tanto, es importantísimo llevar a cabo un seguimiento del efecto que la administración de este material tiene sobre las reproductoras.
Por todo lo anterior, la mejor prevención para combatir las diarreas por CoV es evitar su entrada en la explotación, y para ello es de vital importancia extremar las medidas de bioseguridad:
-
- Cuarentena y diagnóstico precoz en la renovación.
- Prohibición de acceso a vehículos no adecuadamente desinfectados.
- Restricción del acceso y medidas de protección adecuadas para los visitantes.
En el caso de no conseguir evitar su entrada en la granja, sería importante utilizar una serie de medidas a fin de evitar la evolución de los brotes epidémicos hacia presentaciones endémicas:
-
- Introducir toda la renovación necesaria para 4-6 meses, no permitiendo entradas en ese periodo (como mínimo 60 días).
- Exponer a todos los animales de la explotación al virus, especialmente a las reproductoras y a la renovación.
- Higiene y desinfección intensa junto con manejo todo dentro/todo fuera.
- Transcurrido ese periodo, introducir cerdos centinelas y vigilar la aparición de cuadros clínicos de diarrea.
En el próximo capítulos haremos un breve repaso de la importancia de la samonelosis porcina y de aquellos aspectos más relevantes en su prevención y control.
Referencias
Carvajal, A., Argüello, H., Martínez-Lobo, F. J., Costillas, S., Miranda, R., de Nova, P. J. G. and Rubio, P. (2015) «Porcine epidemic diarrhoea: new insights into an old disease», Porcine Health Management. BioMed Central, 1. doi:10.1186/S40813-015-0007-9.
Carvajal, A., Rubio, P., Argüello, H., Gómez Laguna, J. y Miranda Hevia, R. (2018) Diarrea neonatal. 1.a ed. Zaragoza: Grupo Asís Biomedia.
de Nova, P. J. G., Cortey, M., Díaz, I., Puente, H., Rubio, P., Martín, M. and Carvajal, A. (2020) «A retrospective study of porcine epidemic diarrhoea virus (PEDV) reveals the presence of swine enteric coronavirus (SeCoV) since 1993 and the recent introduction of a recombinant PEDV-SeCoV in Spain», Transboundary and Emerging Diseases. John Wiley & Sons, Ltd, 67(6), pp. 2911–2922. doi:10.1111/TBED.13666.
Liu, Q. y Wang, H. Y. (2021) «Porcine enteric coronaviruses: an updated overview of the pathogenesis, prevalence, and diagnosis», Veterinary Research Communications, 45(2-3), pp. 75-86. doi:10.1007/s11259-021-09808-0.
Prieto Suárez, C., Martínez Lobo, F. J., Segalés i Coma, J. y Carvajal Urueña, A. (2017) Enfermedades infecciosas del ganado porcino. 1.a ed. Zaragoza: Grupo Asís Biomedia.
Puente, H. (2023) Diarreas de etiología vírica en el ganado porcino: aportaciones al diagnóstico y control. Tesis Doctoral. Universidad de León.
Wang, Q., Vlasova, A. N., Kenney, S. P. and Saif, L. J. (2019) «Emerging and re-emerging coronaviruses in pigs», Current opinion in virology. Curr Opin Virol, 34, pp. 39–49. doi:10.1016/J.COVIRO.2018.12.001.
Zimmerman, J. J., Karriker, L. A., Ramirez, A., Schwartz, K., Stevenson, G. W. y Zhang, J. (2019) Diseases of Swine. 11.a ed. Hoboken: John Wiley & Sons. doi:10.1002/9781119350927



